何君强, 熊雯宇, 黄 莹, 刘 斌,2
(1.福建农林大学食品科学学院;
2.福建农林大学国家菌草工程技术研究中心,福建 福州 350002)
糖尿病和手足口病发病率高,已成为重大公共卫生问题,给患者健康和社会经济带来沉重负担.肠道病毒71型(enterovirus 71, EV71)是小核糖核酸病毒科肠道病毒属的一种嗜神经性病毒,也是婴幼儿手足口病的主要病原体[1].目前,关于高效抗EV71感染药物的研究多处于基础试验阶段.市面上用于治疗糖尿病的药物虽然可以有效控制血糖水平,但对患者肠道功能的副作用不容忽视.食药用菌是一类珍贵的佳肴与药材,除了含有丰富的矿物质、氨基酸和维生素等营养物质外,还富含多种具有降血糖、血脂,增强机体免疫,抗病毒和肿瘤等药理作用的活性物质[2].蔡超等[3]研究结果显示皱盖假芝和枣翘鳞肉齿菌的水提物对HSV-1、EV71-CSFI4和EV71-PTPS病毒均具有较好的抑制效果.张雪松等[4]发现羊肚菌、桑黄、灵芝、蝉花、虫草水提取物对4种糖苷酶均有不同程度的抑制作用.灰树花(Grifolafrondosa)隶属多孔菌科树花菌属,是一种大型药食两用真菌[5],含有多种生物活性物质,如可抑制EV71复制的新型多糖GFP1[6]和具有降血糖作用的多糖GFP-W[7].目前关于灰树花其他活性成分的相关研究较少.Chen et al[8]仅发现灰树花醇提物中的吡咯生物碱对α-葡萄糖苷酶表现出抑制作用.
本研究拟以70%乙醇作为提取溶剂,按照极性从低到高依次萃取,得到不同极性萃取物,研究各萃取物对α-葡萄糖苷酶和EV71的抑制作用;
同时利用超高效液相色谱质谱联用(ultra-performance liquid chromatography-mass spectrometry, UPLC-MS)和分子对接技术,分析萃取物中发挥活性作用的潜在活性物质及其相互作用模式,以期发现灰树花中具有降血糖和抗病毒作用的活性物质,为以灰树花作为功能性食品进行开发和利用提供依据.
1.1 供试材料
灰树花子实体购于浙江省龙泉市建松土特产经营部,经福建农林大学国家菌草工程技术研究中心鉴定;
人恶性胚胎横纹肌瘤细胞(RD细胞)由中国科学院上海细胞库提供;
EV71由南京大学提供;
无水乙醇、石油醚、乙酸乙酯、正丁醇(分析纯)购于国药集团化学试剂有限公司;
磷酸盐缓冲液、阿卡波糖、α-葡萄糖苷酶、对硝基苯-α-D-葡萄糖吡喃苷(PNPG)、甲醇、乙腈(色谱纯)购于上海麦克林生化科技有限公司;
CCK-8试剂盒购于北京兰博利德生物技术有限公司;
DMEM高糖液体培养基、血清、青霉素、链霉素、胰酶购于Biosharp公司.
1.2 仪器与设备
DHG-9240A电热恒温干燥箱由上海一恒科技有限公司提供;
HH-3A数显三用水浴锅由金坛市精达仪器制造厂提供;
KH20R-Ⅱ高速离心机由湖南凯达科学仪器有限公司提供;
MCO-5M型三气培养箱由日本PHCbi公司提供;
FD-3冷冻干燥机由上海五久自动化设备有限公司提供;
MK3型酶标仪、Vanquish液相色谱仪、QE-HF-X质谱仪均由美国Thermo公司提供.
1.3 方法
1.3.1 灰树花醇提物不同极性萃取物的制备 取灰树花子实体烘干,经粉碎机粉碎至粗粉,以70%乙醇作为溶剂,在50 ℃下超声提取2次,每次1 h,合并提取液,减压浓缩得到灰树花70%乙醇提取物.将70%乙醇提取物用适量蒸馏水充分溶解后,采用液液萃取法依次用石油醚、乙酸乙酯、正丁醇萃取至有机层无色,合并各萃取液,浓缩干燥得到石油醚萃取物、乙酸乙酯萃取物、正丁醇萃取物和水溶物.
1.3.2α-葡萄糖苷酶抑制率的测定 参照文献[9],并稍作修改.利用磷酸盐缓冲液(0.1 mmol·L-1,pH=6.8)配制1 000.0、500.0、250.0、125.0、62.5 μg·mL-1的萃取物.取30 μL样品置于孔板中,加入30 μLα-葡萄糖苷酶(0.2 U·mL-1)于37 ℃下静置10 min;
加入30 μL的底物P-NPG (5 mmol·L-1),37 ℃下孵育15 min;
加入90 μL Na2CO3溶液(0.1 mol·L-1)终止反应,测定光密度(D405 nm).以相同浓度的阿卡波糖作为阳性对照,用磷酸盐缓冲液替代样品作为对照组,用磷酸盐缓冲液替代α-葡萄糖苷酶作为背景组.计算公式表示如下:
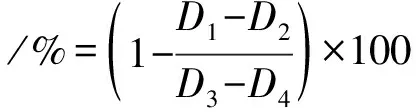
式中:D1为试验组的D405 nm;
D2为试验背景组的D405 nm;
D3为对照组的D405 nm;
D4为对照背景组的D405 nm.
1.3.3 物质毒性的测定 取处于对数生长期的RD细胞,用胰蛋白酶消化2 min后用10% DMEM培养基制成每孔含有5 000个细胞的细胞悬液,铺入孔板中,置于培养箱中培养(37 ℃,5%CO2).待细胞生长至60%~70%时,弃去上清液,加入800、400、200、100、50、25 μg·mL-1萃取物,在2%DMEM培养基中继续培养,每个浓度设置6个重复,同时设置阴性对照组和不加细胞的空白组.培养48 h后,每孔加入10 μL CCK-8试剂,继续培养2 h后测定D450 nm.计算细胞活力:

式中:D0为不加细胞和不加样品的D450 nm;
D1为加细胞和样品的D450 nm;
D2为加细胞和不加样品的D450 nm.
1.3.4 抗EV71活性测定 取RD细胞悬液铺于孔板中培养24 h,然后每孔加入10 μL的EV71病毒溶液;
继续培养2 h后,加入400、200、100、50、25 μg·mL-1萃取物与利巴韦林,每个浓度设置6个重复.同时设置模型组、阴性对照组和阳性对照组.24 h后,利用CCK-8试剂盒测定D450 nm.计算病毒抑制率:

式中:D0为加病毒、不加样品的D450 nm;
D1为加病毒和样品的D450 nm;
D2为不加病毒和样品的D450 nm.
1.3.5 化学成分分析 色谱条件:ACQUITY UPLC®HSS T3(1.8 μm,2.1 mm×150 mm),流速0.25 mL·min-1,柱温40 ℃,进样量2 μL.流动相(负离子模式):5 mmol·L-1甲酸铵水(A)+乙腈溶液(B).流动相(正离子模式):0.1%甲酸水(C)+0.1%甲酸乙腈(D).洗脱程序:0~1 min,2%B/D;
1~9 min,2%~50%B/D;
9~12 min,50%~98%B/D;
12.5~13.5 min,98%B/D;
13.5~14.5 min,2%~98%B/D.
质谱条件:采用电喷雾离子源(ESI),正负离子电离模式,以分辨率70 000进行全扫描,其中毛细管温度为325 ℃,碰撞电压为30 eV.
1.3.6 蛋白靶点分子对接 化合物结构式来自PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/),之后导入Chem3D软件,利用MM2模块进行优化以及能量最小化,保存为sdf格式文件,作为分子对接的配体分子.利用RCSB数据库(https://www.rcsb.org/)寻找a-glucosidase与EV71病毒衣壳蛋白VP1[6]的结构,之后利用Schrödinger软件包对蛋白进行能量最小化,以及几何结构的优化.在Autodock中导入化合物与蛋白分子,根据蛋白结构的预测信息确定其结合位点,盒子大小设置为20 Å×20 Å×20 Å,格点距离为0.375 Å.最后通过标准精度对接方法进行分子对接及筛选.将对接后化合物与蛋白形成的复合物利用Pymol 2.1软件进行可视化,得到化合物与蛋白的结合模式.
1.4 数据处理
试验重复3次,结果以平均值±标准差表示.采用GraphPad Prism 7.0等软件对数据进行处理、分析和绘图.
2.1 灰树花醇提物不同极性萃取物对α-葡萄糖苷酶的抑制作用
α-葡萄糖苷酶参与将淀粉分解为葡萄糖的过程,导致血糖水平升高.因此,α-葡萄糖苷酶是2型糖尿病治疗的重要靶点.α-葡萄糖苷酶抑制剂不仅能延缓葡萄糖的水解和吸收,有效控制餐后血糖水平,还能保护胰岛细胞,缓解糖尿病并发症[10].由图1可知,62.5~1 000.0 μg·mL-1萃取物对α-葡萄糖苷酶均具有抑制作用,对α-葡萄糖苷酶的抑制率随着萃取物浓度的增大而增大,呈现一定的量效关系.1 000 μg·mL-1正丁醇萃取物对α-葡萄糖苷酶的抑制率达到95%以上(抑制作用显著).通过计算IC50可知不同含量萃取物和阿卡波糖对α-葡萄糖苷酶的抑制能力由大到小依次为:(174.12±10.67) μg·mL-1正丁醇萃取物>(216.41±13.21) μg·mL-1阿卡波糖>(322.49±7.31) μg·mL-1石油醚萃取物>(378.74±20.01) μg·mL-1水溶物>(596.55±18.14) μg·mL-1乙酸乙酯萃取物.结果显示正丁醇萃取物对α-葡萄糖苷酶的抑制效果强于其他萃取物及阿卡波糖.黄余燕等[11]研究结果也表明正丁醇萃取物对α-葡萄糖苷酶具有较好的抑制作用,但是萃取物中发挥作用的活性成分还有待进一步研究.
2.2 灰树花醇提物不同极性萃取物对RD细胞增殖能力的影响
由图2可知,当各萃取物浓度低于400 μg·mL-1时,各萃取物作用后的细胞活力与正常模型组相比无显著差异(P>0.05),表明在此浓度范围内RD细胞能正常生长.与正常组相比,800 μg·mL-1石油醚萃取物和水溶物作用后的细胞活力存在明显差异(P<0.05).为了不影响样品抗病毒效果的评估,选取25~400 μg·mL-1萃取物进行抗EV71活性研究.

*表示与阳性对照组(阿卡波糖)相比差异显著(P<0.05).图1 灰树花醇提物不同极性萃取物对α-葡萄糖苷酶的抑制效果Fig.1 Inhibitory effect of different solvent extracts from G. frondosa ethanal extract on α-glucosidase

*表示与正常组相比差异显著(P<0.05).图2 灰树花醇提物不同极性溶剂萃取物对RD细胞的的毒性作用Fig.2 Toxic effect of different solvent extracts from G. frondosa ethanal extract on RD cells
2.3 灰树花醇提物不同极性萃取物的抗EV71活性
EV71属于小RNA病毒科A型肠道病毒属,感染后可能引起神经系统症状或心肌炎性心脏病等并发症,接种疫苗是预防EV71感染的有效方法[12].为降低利巴韦林的毒副作用,选择100 μg·mL-1利巴韦林作为阳性对照[13].由图3可知,各萃取物对EV71的抑制作用与质量浓度呈正比,当质量浓度低于50 μg·mL-1时,各萃取物对EV71的抑制率低于50%.石油醚萃取物与乙酸乙酯萃取物对EV71的抑制作用较弱,当质量浓度为400 μg·mL-1时,抑制率为50%左右.100 μg·mL-1正丁醇萃取物的抑制率达55%以上,200 μg·mL-1正丁醇萃取物对EV71的抑制作用显著高于利巴韦林(P<0.05).400 μg·mL-1水溶物的抗病毒效果明显强于利巴韦林(P<0.05).通过计算IC50可知,不同极性萃取物对EV71的抑制能力由大到小依次为:(84.41±5.12) μg·mL-1正丁醇萃取物>(121.56±12.35) μg·mL-1水溶物>(289.48±14.41) μg·mL-1石油醚萃取物>(393.37±30.93) μg·mL-1乙酸乙酯萃取物.水溶物的抗病毒作用可能源于含有的多糖成分[6],而正丁醇萃取物的抗EV71效果强于水溶物,但是发挥作用的活性成分尚不明确.
2.4 正丁醇萃取物的化学成分分析
与其他萃取物相比,正丁醇萃取物对α-葡萄糖苷酶和EV71的抑制效果较好.通过峰面积列出正丁醇萃取物中相对含量较高的10个化合物,表1显示正丁醇萃取物主要含有氨基酸、甾醇、酯类和核苷类物质,其中,含量最高的4-氨基丁酸是一种重要的中枢神经系统抑制性神经递质,具有改善机体睡眠质量的生理功效[14],L-色氨酸常用作食品强化剂、抗氧剂[15].研究[16]表明氨基酸能促进胰高血糖素的分泌,从而使血糖水平升高.植物鞘氨醇和麦角甾醇对肿瘤细胞活性具有显著的抑制作用,但是Chen et al[8]发现麦角甾醇及其衍生物不是灰树花发挥降血糖作用的相关成分.5-甲基硫代腺苷能诱导结肠癌细胞凋亡[17],尿苷具有促进心肌细胞代谢,加速蛋白质、核酸的生物合成和能量产生等作用[18].糖醇和酚类化合物能够为机体清除自由基[19],庚二酸常被用作生物素合成的前体[20].
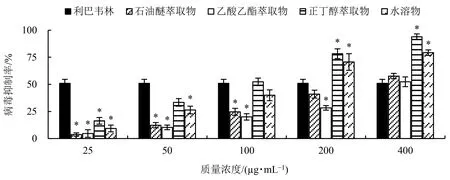
*表示与阳性对照组(利巴韦林)相比差异显著(P<0.05).图3 灰树花醇提物不同极性溶剂萃取物对EV71的抑制作用Fig.3 Inhibitory effect of different solvents extracts from G. frondosa ethanal extract on EV71

表1 正丁醇萃取物的UPLC-MS分析Table 1 UPLC-MS analysis of n-butanol extract
周丽琬等[21]发现薏苡仁中的顺式-亚油酸甲酯对α-葡萄糖苷酶有较强的抑制作用;
Su et al[22]的试验结果显示灰树花正己烷提取物中的亚油酸可能是其发挥α-葡萄糖苷酶抑制作用的活性物质.此外,广泛存在于自然界中的酯类化合物对人体健康也有积极的作用[23-24].
2.5 分子对接
通过分子对接研究亚油酸甲酯、α-葡萄糖苷酶和VP1蛋白之间的结合活性与结合模式.分子对接结果显示亚油酸甲酯与α-葡萄糖苷酶的得分为-28.82 kJ·mol-1,而VP1的得分为-26.36 kJ·mol-1.一般认为得分值<-20.92 kJ·mol-1则表示化合物与靶点之间有较好的结合活性[25],表明亚油酸甲酯、α-葡萄糖苷酶和VP1之间均存在良好的结合活性.
根据结合模式可以看到亚油酸甲酯与α-葡萄糖苷酶相结合的氨基酸残基(图4).亚油酸甲酯可与ASN-258形成氢键,且氢键较短(平均长度为2.6 Å),远小于传统氢键的长度(3.5 Å),结合能力强.另外,该化合物具有很强的疏水性,能够与PHE-282、 PRO-223、PHE-225、ILE-143、PHE-144、TYR-388、MET-385、PHE-163、ALA-200氨基酸形成π-π共轭相互作用,对稳定小分子有重要作用.

A.3D结合模式图;B.2D结合模式图;C.详细结合模式图.图4 亚油酸甲酯与α-葡萄糖苷酶的结合模式图Fig.4 Binding mode of methyl linoleate with α-glucosidase
如图5所示,亚油酸甲酯结合在VP1蛋白口袋深处,与VP1蛋白存在氢键及疏水的相互作用.亚油酸甲酯通过氢键与ASN-228、CYS-225氨基酸结合,并与MET-230、MET-229、PRO-226、ALA-224、ALA-275、ILE-113、ILE-111、PHE-204、TRP-203氨基酸存在很强的疏水作用,可有效促使亚油酸甲酯与VP1蛋白形成稳定的复合物,从而阻止病毒进入细胞.
综上,亚油酸甲酯、α-葡萄糖苷酶和EV71的靶点蛋白在对接打分以及结合模式方面均存在较好表现,与蛋白关联性较强.表明亚油酸甲酯具有与α-葡萄糖苷酶和EV71结合的能力,从而发挥α-葡萄糖苷酶竞争抑制和阻止病毒入侵细胞的作用.
本研究比较了灰树花醇提物不同极性溶剂萃取物对α-葡萄糖苷酶和EV71的抑制作用,结果显示正丁醇萃取物对EV71的抑制作用较强;
同时对α-葡萄糖苷酶的抑制效果强于阿卡波糖.UPLC-MS与分子对接结果表明亚油酸甲酯在正丁醇萃取物中的含量较高,且可利用α-葡萄糖苷酶与EV71表面活性位点相结合而发挥活性作用.本研究发现灰树花正丁醇萃取物对α-葡萄糖苷酶和EV71病毒具有较强的抑制作用,亚油酸甲酯可作为治疗糖尿病和手足口病的潜在活性成分.

A.3D结合模式图;B.2D结合模式图;C.详细结合模式图.图5 亚油酸甲酯与VP1蛋白的结合模式图Fig.5 Binding mode of methyl linoleate with VP1 protein
[1] WEN W H, QI Z X, WANG J. The function and mechanism of enterovirus 71 (EV71) 3C protease[J]. Current Microbiology, 2020,77(9):1968-1975.
[2] 熊雯宇,何君强,黄梓芮,等.食药用菌活性成分对酒精性肝损伤防护作用研究进展[J].食品工业,2022,43(4):221-225.
[3] 蔡超,雷苏炜,陈少丹,等.十七种食药用菌提取物抗病毒活性筛选[J].食用菌学报,2020,27(1):75-84.
[4] 张雪松,刘焕颍,谢春芹,等.珍稀食药用菌水提取物对糖苷酶的抑制[J].北方园艺,2020(6):126-133.
[5] XIAO C, WU Q P, XIE Y Z, et al. Hypoglycemic effects ofGrifolafrondosa(Maitake) polysaccharides F2 and F3 through improvement of insulin resistance in diabetic rats[J]. Food & Function, 2015,6(11):3567-3575.
[6] ZHAO C, GAO L Y, WANG C Y, et al. Structural characterization and antiviral activity of a novel heteropolysaccharide isolated fromGrifolafrondosaagainst enterovirus 71[J]. Carbohydrate Polymers, 2016,144:382-389.
[7] CHEN Y, LIU Y, SARKER M M R, et al. Structural characterization and antidiabetic potential of a novel heteropolysaccharide fromGrifolafrondosavia IRS1/PI3K-JNK signaling pathways[J]. Carbohydrate Polymers, 2018,198:452-461.
[8] CHEN S D, YONG T Q, XIAO C, et al. Pyrrole alkaloids and ergosterols fromGrifolafrondosaexert anti-α-glucosidase and anti-proliferative activities[J]. Journal of Functional Foods, 2018,43:196-205.
[9] 汤宇青,吕峰,林海兰,等.石莼水溶性膳食纤维的理化性质及体外降血糖的活性[J].福建农林大学学报(自然科学版),2017,46(6):702-707.
[10] DJEUJO F M, FRANCESCONI V, GONELLA M, et al. Anti-α-glucosidase and antiglycation activities ofα-mangostin and new xanthenone derivatives: enzymatic kinetics and mechanistic insights throughinvitrostudies[J]. Molecules, 2022,27(2):547.
[11] 黄余燕,罗宝平,李淑敏,等.山莓果实不同极性萃取物降血糖作用研究[J].亚太传统医药,2022,18(10):87-90.
[12] 林锦霞,于娟,陈志亮,等.片仔癀抗EV71型肠道病毒的研究[J].中国中药杂志,2022,47(5):1343-1349.
[13] 董娜,康永平.匹多莫德联合利巴韦林治疗对手足口病患儿疗效及对D-二聚体含量的影响[J].血栓与止血学,2022,28(3):663-664.
[14] 莫小叶,骆鹏飞,俞兰秀,等.富含γ-氨基丁酸酸奶对小鼠睡眠的促进作用[J].现代食品科技,2020,36(11):29-35.
[15] 苏建民.大肠杆菌发酵液中L-色氨酸的分离纯化[D].福州:福建师范大学,2021:2-3.
[16] 余爱勇,赵迎春,赵玉武,等.血糖升高速度对糖尿病模型大鼠低血糖性脑损伤的影响[J].临床神经病学杂志,2018,31(2):126-129.
[17] 张青松.5′-甲基硫代腺苷对结肠癌细胞凋亡的影响及其相关机制的研究[D].天津:天津医科大学,2008:23-24.
[18] 刘怡琳.尿苷对肥胖和高脂饮食小鼠肝脏代谢的影响及其调控机制研究[D].南昌:南昌大学,2021:15.
[19] 李小奇,金汉宏,吴继炎,等.不同剂量低浓度甘露醇对重度烧伤氧自由基清除效果的影响[J].全科医学临床与教育,2018,16(2):190-192.
[20] 朱平华.1,7-庚二酸的合成研究[J].化学世界,2006(4):222-224.
[21] 周丽琬,李颖,陈惠琴,等.薏苡仁脂肪酸的α-葡萄糖苷酶抑制活性[J].食品工业,2022,43(6):216-220.
[22] SU C H, LU T M, LAI M N, et al. Inhibitory potential ofGrifolafrondosabioactive fractions onα-amylase andα-glucosidase for management of hyperglycemia[J]. Biotechnol Appl Biochem, 2013,60(4):446-452.
[23] 肖冬光.白酒酿造过程中酯类物质形成机理探讨[J].酿酒科技,2022(9):17-24.
[24] 秦慧真,林思,邓玲玉,等.穿心莲内酯药理作用及机制研究进展[J].中国实验方剂学杂志,2022,28(6):272-282.
[25] 梁建文,王晋平,谢荣鑫,等.淫羊藿治疗阿尔茨海默病作用机制的网络药理学与分子对接研究[J].湖北民族大学学报(医学版),2022,39(1):6-11.
猜你喜欢提物亚油酸正丁醇岭南山竹子醇提物对溃疡性结肠炎小鼠的作用世界科学技术-中医药现代化(2022年3期)2022-08-22正丁醇和松节油混合物对组织脱水不良的补救应用承德医学院学报(2022年2期)2022-05-23NH3和NaCl对共轭亚油酸囊泡化的影响中国洗涤用品工业(2019年4期)2019-05-11大风子正丁醇部位化学成分的研究中成药(2018年9期)2018-10-09三叶青藤正丁醇部位化学成分的研究中成药(2018年7期)2018-08-04中华抱茎蓼正丁醇部位化学成分的研究中成药(2018年3期)2018-05-07飞龙掌血醇提物的抗炎镇痛作用中成药(2018年1期)2018-02-02阿纳其根醇提物对冈田酸诱导PC12细胞损伤的保护作用中成药(2017年9期)2017-12-19葫芦钻水提物的抗炎镇痛作用及其急性毒性中成药(2017年5期)2017-06-13冷冻丙酮法提取山核桃油中的亚油酸和亚麻酸食品界(2016年4期)2016-02-27