王欢欢 李婉婷 史雅文 吴虹 刘树森 吴婷 殷敏
阻塞性睡眠呼吸暂停(obstructive sleep apnea,OSA)是一种常见的睡眠呼吸障碍疾病,OSA的病理生理变化为慢性间歇性低氧(chronic intermittent hypoxia,CIH)和睡眠结构紊乱。研究提示睡眠结构异常会增加OSA患者生物钟紊乱的风险[1,2],CIH也可以引起生物钟基因[3]的改变。昼夜节律是指生命活动以24h左右为周期的生物振荡现象,人体中几乎所有的细胞和器官在生理和基因水平上均存在特定的昼夜节律模式,如睡眠-觉醒周期、血压、心率、肌肉活动、激素分泌等等。OSA的主要病因是上气道肌肉的活性下降[4],舌下神经元是调控上气道肌肉的主要中枢之一,而舌下神经元在觉醒、非快速眼动相睡眠、快速眼动相睡眠的活性逐渐下降[5],而5-HT神经元等活性也遵循着相似的规律[6,7]。5-HT可能是OSA的生物标志物,我们在CIH条件下大鼠舌下神经核[8,9]和OSA患者血清5-HT[10]都观察到了不同程度的变化,但是OSA/CIH条件下5-HT的节律变化仍需要进一步研究。褪黑素(melatonin,MT)主要由松果体在夜间合成和分泌,可以稳定和加强昼夜节律的耦合,尤其是睡眠-觉醒节律。而许多病理生理情况下,MT的分泌会受到干扰。健康人的MT高峰发生在夜间,而OSA患者夜间MT水平显著降低,并且没有出现夜间峰值[11,12]。因此有待通过动物研究了解CIH条件下MT节律变化。
因此我们的研究试图探索常氧和CIH条件下大鼠血清5-HT和MT不同时间点含量及节律变化,为进一步阐述OSA的病理生理机制提供理论依据。
1 动物与造模
称取36只8周龄且重量在180~200g左右的清洁级SD大鼠(均由江苏省动物试验中心提供)。把SD大鼠随机分成两组:慢性间歇性低氧组(CIH组)和常氧对照组(CON组)。CIH组大鼠每天9∶00~17∶00放置于低氧舱中饲养,循环交替给予60s氮气和60s压缩空气,每一循环120s。同时用测氧仪检测舱内氧体积分数变化,使舱内氧体积分数在 5%~21%之间循环。CON组在常压、大气环境培养舱中饲养,舱内氧体积分数维持在21%。每日CIH造模结束后将动物送入常规饲养箱饲养。两组大鼠饲养于南京医科大学动物中心SPF环境中,饲养环境、温度以及条件均相同。造模持续21d。光照时间固定,明期为07∶00~19∶00,暗期为19∶00~07∶00。本实验方案的伦理申请和动物申请由南京医科大学实验动物伦理委员会批准。伦理编号为IACUC 1901047。
2 酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)取材
造模结束后,第22天开始按照时间段分组取材。两组动物按9∶00、13∶00、15∶00、21∶00、次日1∶00、5∶00点等量分为6小组,每个时间点CIH组和CON组各取3只。称取体重,2%戊巴比妥钠(4mg/100g)腹腔注射麻醉大鼠。待大鼠完全麻醉后,仰卧位放置于实验动物实验台上并固定,手术剪剪除大鼠胸腹部皮毛,手术刀片划开腹部,手术剪刀顺着剑突方向穿过大鼠膈肌,剪开大鼠胸骨柄,打开大鼠胸腔。将注射器对准大鼠心尖,让血液随着心脏搏动自动泵入负压真空采血管。抽取3ml心尖血。静置20min后3000r/min低温离心15min,取上层血清,分装至无菌Ep管中,-80℃保存备用。
3 ELISA实验
大鼠血清5-HT、MT的检测步骤严格按照ELISA检测试剂盒说明书进行。稀释标准品溶液,标准品孔加样50μl,待测样品孔中先加样品稀释液40μl,再加待测样品10μl,空白孔不加样;
37℃孵育1/h;
洗板并充分拍干;
加入50μl酶标试剂;
37℃孵育半小时;
洗板并充分拍干;
依次加入50μl显色剂A、50μl显色剂B,37℃显色反应10min;
加入50μl终止液,观察到蓝色立转黄色时,表示反应终止。根据吸光度和标准品浓度绘制标准曲线,计算样本浓度。
4 统计学处理
采用SPSS 25.0统计软件进行统计分析,数据符合正态分布,结果均以均数±标准差(±s)表示,两组间比较采用独立样本t检验,多组间比较采用方差分析。P<0.05为差异有统计学意义。
1 CIH组和CON组大鼠血清中5-HT的含量及节律变化(表1、图1)
与CON组相比,CIH组血清5-HT平均含量明显增高(P<0.001),其中9∶00、17∶00的升高有统计学意义(P<0.01)。经方差分析,CON组昼夜不同时间点血清5-HT水平的变化无统计学意义(P>0.05),CIH组昼夜不同时间点血清5-HT水平的变化也无统计学意义(P>0.05)。谷值均在21∶00,CON组峰值在1∶00,而CIH组峰值移至9∶00。
2 CIH组和CON组大鼠血清中MT的含量及节律变化(表1、图1)
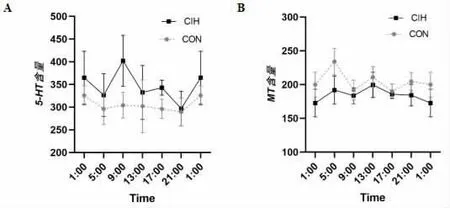
图1 各组大鼠不同时间点血清5-HT、MT含量概括图5-HT:五羟色胺;
MT:褪黑素
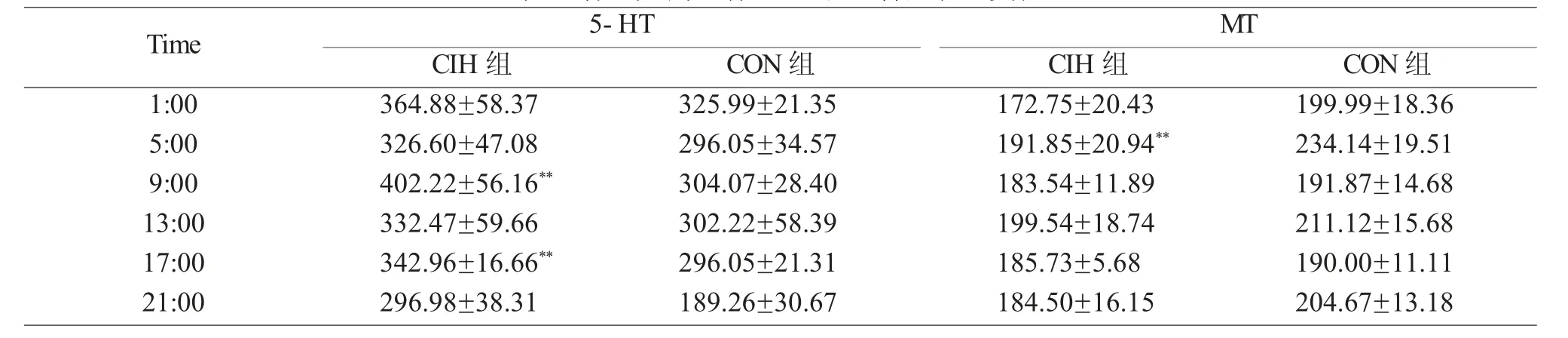
表1 各组大鼠血清5-HT、MT含量表达变化
与CON组相比,CIH组血清平均MT含量明显下降(P<0.001),其中5∶00的下降有统计学意义(P<0.01)。经方差分析,CON组昼夜不同时间点血清MT水平的变化有统计学意义(P<0.05),而CIH组不同时间点血清MT水平的变化无统计学意义(P>0.05)。CON组谷值在17∶00,CIH组谷值移至1∶00,CON组峰值在5∶00,而CIH组峰值移至13∶00。
本研究结果显示,CIH组血清5-HT平均含量增高,而MT平均含量下降。对照组峰值在1∶00,而CIH组峰值移至9∶00。对照组昼夜不同时间点血清MT水平呈现出昼低夜高的分泌模式,而CIH影响了MT的分泌模式,使得MT的分泌趋向于变化不显著。
5-HT参与调节许多生物学过程,包括神经元功能调控、呼吸控制、心血管功能等。本研究发现了CIH条件下血清中5-HT的分泌量增加,有学者推测5-HT可能通过增加呼吸系统对CO2浓度敏感性[12],进而改善缺氧,增加通气量。此外,血清5-HT也可以通过结合5-HT受体(尤其是5-HT2A受体)促进膈、舌下神经元的长时程易化[13],保持上气道的通畅性,进而对缺氧起到一定的代偿作用。在中枢神经系统中,5-HT几乎全部由脑干中缝核的神经元产生,5-HT能神经可以广泛投射到中枢神经系统的大部分区域,包括舌下神经核,然而多数5-HT是中枢神经系统之外来源的[14],本研究结果表明CIH条件下血清5-HT和舌下神经核的变化方向[8,9]并不一致,提示CIH条件下5-HT在血清和中枢的作用机制可能不一致。此外,本研究观察到对照组5-HT峰值在暗期,而CIH组移位至明期,白天大鼠处于CIH的环境中,且大多数啮齿类动物如大鼠在黑暗中较为活跃,而在光照期间睡眠水平较高[15],可能提示白天大鼠的上气道更易松弛塌陷,而5-HT的升高可能通过上述机制[13,14]改善缺氧状态。
MT主要由神经内分泌器官松果体合成,MT的合成受光照条件的影响,白天较低,夜间明显增加[16],与本研究的对照组呈现出昼低夜高的分泌模式基本一致。本研究发现CIH组血清MT表达下降,且干扰了其昼夜节律,而MT在各种生理活动中起着关键作用,包括调节昼夜节律、炎症过程、氧化过程、凋亡等[17],因此MT的下调及节律紊乱一定程度上反应了机体昼夜节律等等多方面的损伤。有研究提示MT干预对CIH所致的心肌[18]、海马[19]等组织损伤有缓解作用,因此对于CIH导致的MT的下降造成的机体损伤是否可以外源性补充MT去改善值得我们进一步研究。
因此,我们对5-HT、MT含量及节律的分析,有助于进一步阐述OSA的病理生理机制。但是本研究受条件限制,样本量小,同时采血的间隔时间可以进一步缩短(如3h、2h、1h),另一方面,不同CIH时程会对机体产生何种影响,也有待我们今后研究进一步深入。
猜你喜欢节律峰值变化“四单”联动打造适龄儿童队前教育峰值体验少先队活动(2022年9期)2022-11-23从9到3的变化学生天地(2020年14期)2020-08-25这五年的变化特别文摘(2018年3期)2018-08-08宽占空比峰值电流型准PWM/PFM混合控制通信电源技术(2016年6期)2016-04-20基于峰值反馈的电流型PFM控制方法通信电源技术(2016年5期)2016-03-22蚬木扦插苗人工幼林生长节律广西林业科学(2016年3期)2016-03-16鸟的变化系列诗选刊(2015年6期)2015-10-26慢性给予GHRP-6对小鼠跑轮运动日节律的影响医学研究杂志(2015年5期)2015-06-10运用节律跳绳,提高跳绳教学质量中国学校体育(2014年4期)2014-12-06更正检验医学(2013年8期)2013-02-19